Reaktionen von Pflanzen auf Sauerstoffmangel
Pflanzen als photoautotrophe Organismen setzen als Abfallprodukt der Photosynthese Sauerstoff frei. Dennoch gibt es bestimmte Organe und Lebensphasen, in denen die Pflanze auf heterotrophe Atmung, d.h. auf die Nutzung von Sauerstoff in den Mitochondrien, angewiesen ist. So können Wurzeln und Blüten normalerweise keine Photosynthese durchführen. Auch die Samenkeimung bedarf einer Deckung des Energiebedarfs durch die mitochondriale Atmungskette. In der Nacht ist die gesamte Pflanze auf den heterotrophen Metabolismus angewiesen.
Unter bestimmten Umständen kann es jedoch dazu kommen, dass die Verfügbarkeit von Sauerstoff limitiert ist. Dies kann in dicht gepackten pflanzlichen Geweben wie Meristemen, Samen und Knollen der Fall sein. Außerdem nimmt in einem verdichteten, staunassen oder überfluteten Boden die Sauerstoffkonzentration sehr schnell ab, und die Pflanze ist dann einem Sauerstoffmangel ausgesetzt.
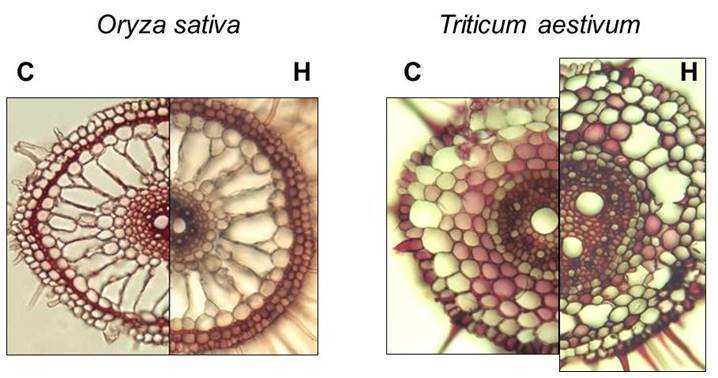
Abb. 1: Wurzelquerschnitte von Reis und Weizen unter Kontrollbedingungen (C) und nach Hypoxie (H).
Die Pflanze kann mit zwei Strategien auf diese Stress-Situation reagieren. Zum einen kann mit Hilfe morphologischer und anatomischer Anpassungen ein Sauerstoffmangel vermieden werden. So können Pflanzen Belüftungsgewebe, sogenannte Aerenchyme, ausbilden (Abb. 1; Mustroph et al. 2003). Weitere Anpassungen sind Elongation der Blätter und Stengel, um die Wasseroberfläche zu erreichen, und die Ausbildung von Luftwurzeln. Pflanzen, die solche Fähigkeiten im starken Maße besitzen, können sehr gut in einer sauerstoffarmen Umgebung wachsen, z.B. an Seeufern oder in Mooren. Beispiele sind die Seerose, das Schilf, der Kalmus, die Erle und der Reis als einzige anpassungsfähige Kulturpflanze. Dagegen sind Weizen, Gerste, Mais, Kartoffeln und Raps sehr empfindlich gegenüber Sauerstoffmangel.
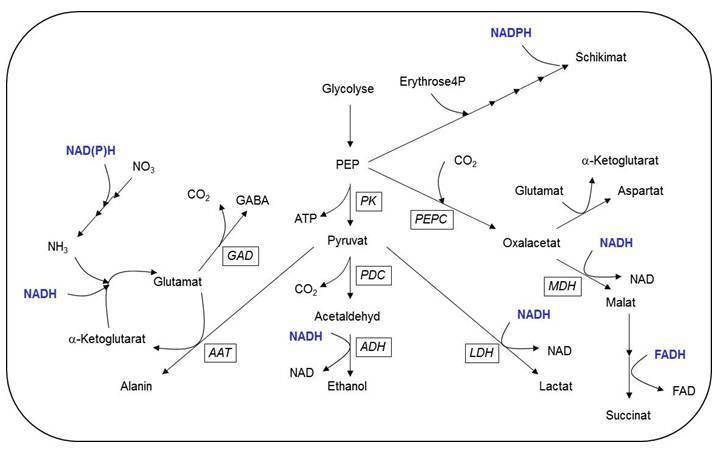
Abb. 2: Fermentationsmechanismen in Pflanzenzellen unter Sauerstoffmangel.
Eine weitere Strategie ist die Toleranz einer Sauerstoffmangel-Situation, bei der der Stoffwechsel daran angepasst wird, mit wenig Sauerstoff auszukommen. In erster Linie wird dabei die Fermentation induziert, um NADH abzubauen, das während der Glycolyse gebildet wird, und mangels Sauerstoff in den Mitochondrien nicht mehr verstoffwechselt werden kann. Dabei produzieren die Pflanzen wenig Lactat und vermehrt Ethanol (Abb. 2; Mustroph et al. 2003, 2006, 2007). Andere Stoffwechselanpassungen sind noch nicht abschließend untersucht worden und beinhalten alternative Fermentationsprodukte wie Alanin, Succinat und GABA (Abb. 2; Branco-Price et al. 2008, Mustroph et al. 2014a), sowie die Nutzung von Pyrophosphat als alternative Energiequelle anstelle von ATP (Abb. 3; Mustroph et al. 2005, Mustroph et al. 2014b).
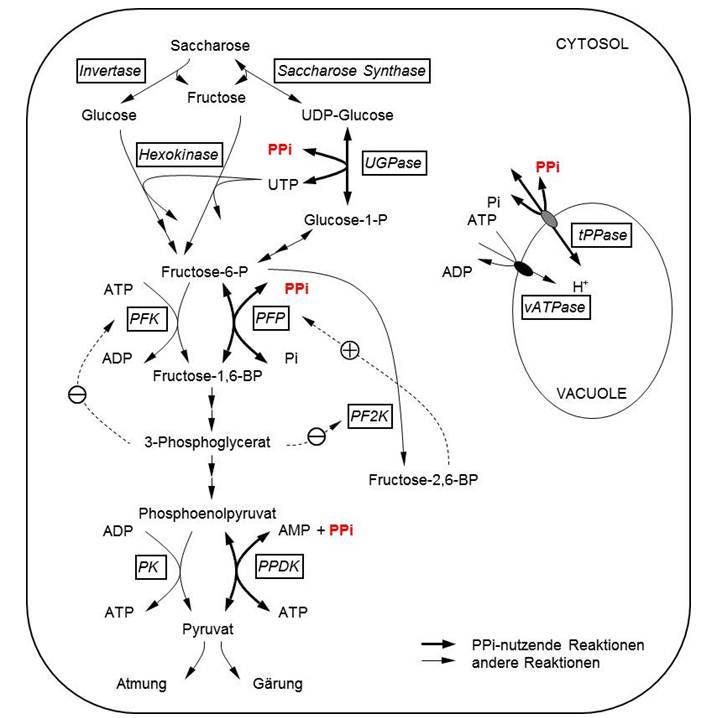
Abb. 3: Pyrophosphat-abhängige Reaktionen in Pflanzenzellen.
Projekte
In unserer Arbeitsgruppe beschäftigen wir uns mit verschiedenen Modellpflanzen, hauptsächlich Arabidopsis thaliana, Oryza sativa (Reis) und Solanum tuberosum (Kartoffel). Mit Hilfe von molekularbiologischen und biochemischen Experimenten versuchen wir, mehr über die Reaktionen von Pflanzen auf Sauerstoffmangel und ihre Regulation zu lernen. Die Analyse von Pflanzen mit Hilfe von Microarray-Experimenten hat gezeigt, dass Sauerstoffmangel die Transkription und Translation vieler Gene verändert (Mustroph et al. 2009, Mustroph et al. 2010, http://efp.ucr.edu/). Erst seit kurzem weiß man, wie die Sauerstoff-Konzentration in der Pflanze gemessen wird, und wie das Signal dann zu einer Veränderung der Genexpression führt (Gibbs et al. 2011, Licausi et al. 2011, Weits et al. 2014). Viele Details sind hierzu jedoch noch unbekannt, und einige unserer Forschungsprojekte beschäftigen sich mit diesem Thema. Auch die Veränderung im Stoffwechsel, insbesondere verschiedene alternative Stoffwechselwege, könnten die Toleranz von Pflanzen gegenüber Sauerstoffmangel beeinflussen, und werden von uns untersucht.
Methoden
Klonierung von Promotoren und Genen
Erstellung, Selektion und Charakterisierung transgener Pflanzen
DNA-, RNA- und Proteinextraktion und Analyse
Immunopräzipitation
Bestimmung von Enzymaktivitäten und Metabolitgehalten
Wachstumsanalysen
Microarray-Analysen und Bioinformatische Auswertung
Literatur
- Branco-Price C, Kaiser KA, Jang CJ, Larive CK, Bailey-Serres J (2008) Selective mRNA translation coordinates energetic and metabolic adjustments to cellular oxygen deprivation and reoxygenation in Arabidopsis thaliana. Plant J 56: 743-755
- Gibbs DJ, Lee SC, Isa NM, Gramuglia S, Fukao T, Bassel GW, Correia CS, Corbineau F, Theodoulou FL, Bailey-Serres J, Holdsworth MJ (2011) Homeostatic response to hypoxia is regulated by the N-end rule pathway in plants. Nature 479: 415-418
- Licausi F, Kosmacz M, Weits DA, Giuntoli B, Giorgi FM, Voesenek LACJ, Perata P, van Dongen JT (2011) Oxygen sensing in plants is mediated by an N-end rule pathway for protein destabilization. Nature 479: 419-422
- Mustroph A, Albrecht G (2003) Tolerance of crop plants to oxygen deficiency stress: Fermentative activity and photosynthetic capacity of entire seedlings under hypoxia and anoxia. Physiol Plant 117: 508-520
- Mustroph A, Albrecht G (2007) Fermentation metabolism in roots of wheat seedlings after hypoxic pre-treatment in different anoxic incubation systems. J Plant Physiol 164: 394-407
- Mustroph A, Albrecht G, Hajirezaei M, Grimm B, Biemelt S (2005) Low levels of pyrophosphate in transgenic potato plants expressing E. coli pyrophosphatase lead to decreased vitality under oxygen deficiency. Annals of Botany, 96: 717-726
- Mustroph A, Barding GA, Kaiser KA, Larive CK, Bailey-Serres J (2014) Characterization of distinct root and shoot responses to low-oxygen stress in Arabidopsis with a focus on primary C- and N-metabolism. Plant Cell Environ 37: 2366-2380
- Mustroph A, Boamfa EI, Laarhoven LJJ, Harren FJM, Albrecht G, Grimm B (2006) Organ specific analysis of the anaerobic primary metabolism in rice and wheat seedlings I: Dark ethanol production is dominated by the shoots. Planta 225: 103-114
- Mustroph A, Hess N, Sasidharan R (2014) Hypoxic energy metabolism and PPi as an alternative energy currency. J.T. van Dongen and F. Licausi (eds.), Low-Oxygen Stress in Plants, Plant Cell Monographs 21: 165-184, Springer-Verlag Wien
- Mustroph A, Lee SC, Oosumi T, Zanetti ME, Yang H, Ma K, Yaghoubi-Masihi A, Fukao T, Bailey-Serres J (2010) Cross-kingdom comparison of transcriptomic adjustments to low oxygen stress highlights conserved and plant-specific responses. Plant Physiol 152: 1484-1500
- Mustroph A, Zanetti E, Jang CJH, Holtan HE, Repetti PP, Galbraith DW, Girke T, Bailey-Serres J (2009) Profiling translatomes of discrete cell populations resolves altered cellular priorities during hypoxia in Arabidopsis. Proc Natl Acad Sci USA 106: 18843-18848
- Weits DA, Giuntoli B, Kosmacz M, Parlanti S, Hubberten HM, Riegler H, Hoefgen R, Perata P, van Dongen JT, Licausi F (2014) Plant cysteine oxidases control the oxygen-dependent branch of the N-end-rule pathway. Nat Commun 5: 3425
